
宾夕法尼亚大学工程师发现了一种引导脂质纳米颗粒(LNPs)——一种用于运送COVID-19疫苗的革命性分子——瞄准特定组织的新方法,预示着个性化
宾夕法尼亚大学工程师发现了一种引导脂质纳米颗粒(LNPs)——一种用于运送COVID-19疫苗的革命性分子——瞄准特定组织的新方法,预示着个性化医疗和基因治疗新时代的到来。
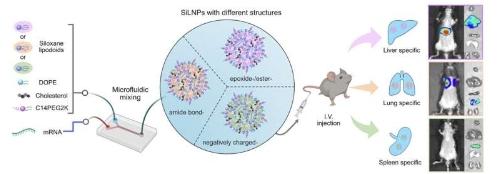
尽管过去的研究(包括宾夕法尼亚大学工程学院的研究)已经筛选了LNP“库”以寻找针对肺等器官的特定变体,但这种方法类似于反复试验。
生物工程副教授MichaelJ.Mitchell表示:“我们从未了解过LNP的一个关键成分——可电离脂质的结构如何决定LNP最终到达肝脏以外的器官。”
在《自然纳米技术》上发表的一篇论文中,米切尔研究小组描述了如何通过对可电离脂质(LNP的关键成分)的化学结构进行细微调整来实现组织特异性输送,特别是向肝脏、肺和脾脏输送。
硅氧烷的力量
研究人员的关键见解是将硅氧烷复合材料(一类已用于医疗器械、化妆品和药物输送的硅基和氧基化合物)掺入可电离脂质中(LNPs由此得名)。
硅氧烷复合材料与以耐用和易于清洁而闻名的硅家居用品非常相似,之前的研究表明硅氧烷复合材料具有高稳定性和低毒性。研究人员在论文中报告说:“我们试图探索是否可以利用这些特性来设计高度稳定、毒性最小的LNP用于mRNA递送。”
通过仔细测试数百种新命名的硅氧烷掺入脂质纳米颗粒(SiLNP),研究人员确定了哪些化学特征对mRNA传递有影响。
“确定它们在体内的输送方式是一个巨大的挑战,”米切尔实验室的博士后研究员、该论文的共同第一作者之一薛璐璐说。
找到正确的公式
起初,研究人员使用SiLNP变体将编码萤火虫荧光素酶(一种使萤火虫发光的基因)的mRNA递送到动物模型中的癌性肝细胞中,作为使用SiLNP治疗肝癌的替代方法。无论细胞在哪里开始发光,研究人员都可以确信SiLNP已将其mRNA有效载荷转移到细胞中。
当动物模型的肺部也出现发光细胞时,研究人员意识到某些SiLNP变体正在引导肝脏外的分子——这是LNP研究的目标,因为由于肝脏血管网络复杂,LNP往往聚集在肝脏中。
研究小组发现,调整SiLNP轨迹的变化包括一些非常小的调整,例如用一个化学基团替代另一个化学基团(在本例中是用酰胺替代酯),这使得在动物模型中将mRNA递送到肺组织的成功率达到90%。
薛说:“我们只是改变了脂质的结构,但脂质化学上的这一微小变化却大大增加了肝外输送。”
新效果、新应用
研究小组还确定,多种化学因素影响SiLNPs的整体功效,包括脂质中硅基团的数量、脂质尾部的长度以及脂质本身的结构。
此外,SiLNPs对内皮细胞具有显著的亲和力。由于血管是由内皮细胞构成的,SiLNPs可能在针对受损血管(特别是肺部血管)的再生医学中具有临床应用。
事实上,研究人员发现,在患有病毒感染而损害肺部血管的动物模型中,输送促进新血管生长的物质的SiLNPs显著改善了血氧水平和肺功能。
研究人员推测,SiLNPs之所以有效,原因之一可能是硅原子比碳原子大。由于原子排列不太紧密,当SiLNPs与靶细胞膜融合时,前者可能会增加后者的流动性。
这种额外的灵活性反过来又有助于SiLNP携带的mRNA进入靶细胞,因此mRNA可以更容易地用于生产蛋白质。当SiLNP穿过血流时,附着在其表面的蛋白质也有助于引导它们到达正确的组织。
最终,与目前的金标准LNP品种相比,SiLNP在传递mRNA方面表现出了六倍的改善,这表明硅氧烷复合材料的独特性质对分子的临床潜力具有显著的影响。
薛其坤说:“这些SiLNPs在蛋白质替代疗法、再生医学和基于CRISPR-Cas的基因编辑方面展现出了良好的前景。”
米切尔补充道:“我们希望这篇论文能够为脂质纳米粒子带来新的临床应用,通过展示如何通过简单的化学结构改变来实现高度特异性的mRNA递送到目标器官。”
声明本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们