
大多数蛋白质定位于细胞中不同的富含蛋白质的液滴,也称为细胞凝聚物。这些蛋白质包含作为地址标签的序列特征,告诉蛋白质进入哪个凝聚物。
大多数蛋白质定位于细胞中不同的富含蛋白质的液滴,也称为“细胞凝聚物”。这些蛋白质包含作为地址标签的序列特征,告诉蛋白质进入哪个凝聚物。当标签被搞砸时,蛋白质最终可能会进入错误的冷凝物中。根据一个来自临床医学和基础生物学的国际研究小组的说法,这可能是许多未解决疾病的原因。研究结果发表在《自然》杂志上。
BPTA 综合征患者具有特征性的肢体畸形,包括手指短和脚趾,腿部胫骨缺失,大脑尺寸减小。正如研究人员发现的那样,BPTAS是由一种特殊的遗传变化引起的,这种变化导致必需蛋白质迁移到细胞核仁,核仁是细胞核中的大蛋白质液滴。结果,核仁凝聚物的功能受到抑制,发育疾病发展。
“我们在这种疾病中发现的可能适用于更多的疾病。它可能不是只存在一次的稀有独角兽。直到现在我们才看到这种现象,因为我们不知道如何寻找它,“柏林夏里特医学院医学与人类遗传学研究所的临床遗传学家Denise Horn说。
该团队与柏林马克斯普朗克分子遗传学研究所(MPIMG),石勒苏益格 - 荷尔斯泰因大学医院(UKSH)的科学家以及来自世界各地的贡献者合作,正在为新的诊断打开大门,这些诊断可能导致许多其他疾病的阐明以及可能的未来疗法。
“我们发现了一种新机制,可以在多种疾病中发挥作用,包括遗传性疾病和癌症,”MPIMG研究小组负责人Denes Hnisz说。“事实上,我们已经发现了600多个类似的突变,其中101个已知与不同的疾病有关。
“实际的工作现在才刚刚开始,”吕贝克和基尔UKSH的人类遗传学家Malte Spielmann补充道。“我们将发现更多具有这种致病突变的基因,现在可以测试它们的作用方式。
不寻常的突变
受影响的个体具有复杂而引人注目的四肢、面部、神经和骨骼系统畸形,仅部分描述为已经很长的疾病名称“短指趾多指胫骨发育不全/发育不全综合征”(BPTAS)。
“全世界记录在案的病例不到十例,这种疾病不仅罕见,而且非常罕见,”夏里特医学院医学与人类遗传学研究所的临床遗传学家Martin Mensah说。为了追踪原因,他和他的同事解码了五个受影响个体的基因组,发现HMGB1蛋白的基因在所有患者中都发生了改变。
这种蛋白质的任务是组织细胞核中的遗传物质,并促进其他分子与DNA的相互作用,例如读取基因。
在小鼠中,两条染色体上的基因完全丧失是灾难性的,并导致胚胎死亡。然而,在一些只有一个拷贝突变的患者中,细胞使用另一条染色体上的完整拷贝,仅导致轻度神经发育迟缓。但新发现的病例并不符合这一方案。
“所有五个无关的个体都具有相同的超罕见疾病,并且具有几乎相同的突变,”Mensah说,他是柏林夏里特卫生研究所(BIH)和Charité运营的临床科学家计划的研究员。“这就是为什么我们确信HMGB1突变是疾病的原因。然而,在这一点上,我们不知道基因产物如何在功能上引起疾病,特别是考虑到据报道功能丧失突变导致其他表型。
带电的蛋白质延伸
仔细观察发现,HMGB1的不同突变具有不同的后果。测序数据显示,在严重畸形的受影响个体中,HMGB1基因最后三分之一的阅读框发生了偏移。
在转化为蛋白质后,相应的区域现在不再配备负电荷,而是配备带正电荷的氨基酸构建块。如果序列中缺少许多不能被三整除的遗传字母,就会发生这种情况,因为恰好三个连续的字母总是编码蛋白质的一个构建块。
然而,蛋白质的尾部没有明确的结构。相反,这部分像松散的橡皮筋一样悬挂在分子之外。这种蛋白质尾巴(也称为“固有无序区域”)的目的很难研究,因为它们通常只有与其他分子结合时才有效。那么它们的突变如何导致观察到的疾病呢?
细胞中的蛋白质液滴
为了回答这个问题,医学研究人员联系了MPIMG的生物化学家Denes Hnisz和Henri Niskanen,他们研究控制重要基因的细胞凝聚物。这些液滴状结构的行为很像沙拉酱中的油和醋液滴。它们由大量不同的分子组成,与周围环境分离,可以发生动态变化。
“我们认为冷凝物是在细胞中形成的,是出于实际原因,”Niskanen解释说。用于特定任务的分子以这种方式组合在一起,例如读取基因。他说,仅就这项任务而言,就需要数百种蛋白质以某种方式到达正确的位置。
“内在无序的区域,往往没有明显的生化作用,被认为是形成冷凝物的原因,”Niskanen说,举了一个例子来描述蛋白质延伸的物理性质在这方面的重要性。“我可以很容易地用许多松散的橡皮筋做成一个球,这些橡皮筋相对紧密地结合在一起,可以毫不费力地拆开。另一方面,一团光滑的钓鱼线或粘性胶带的行为会完全不同。
凝固液滴
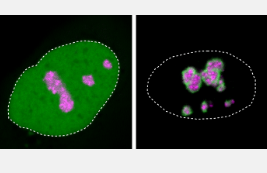
细胞核内的核仁也是凝聚物,在显微镜下表现为弥漫性黑斑。这是许多带有正电荷尾巴的蛋白质喜欢徘徊的地方。其中许多提供了蛋白质合成所需的机制,使这种冷凝物对细胞功能至关重要。
带有正电荷的分子尾巴的突变蛋白HMGB1也被吸引到核仁上,正如研究小组从分离的蛋白质和细胞培养物的实验中观察到的那样。
但是由于突变的蛋白质区域也获得了油性,粘性部分,因此它往往会结块。核仁失去其流体状特性并逐渐凝固,Niskanen能够在显微镜下观察到这一点。这损害了细胞的重要功能 - 与没有突变的细胞培养物相比,使用突变的蛋白质,培养物中更多的细胞死亡。
梳理数据库
然后,研究小组搜索了数千名个体的基因组数据数据库,寻找类似的事件。事实上,科学家们能够在66种蛋白质中鉴定出六百多个类似的突变,其中阅读框被蛋白质尾部的突变所移动,使其既带正电荷又更“油腻”。在这些突变中,有101个以前与几种不同的疾病有关。
对于细胞培养测定,研究小组选择了13个突变基因。在12例中的13例中,突变蛋白倾向于定位到核仁中。大约一半的测试蛋白质损害了核仁的功能,类似于BPTA综合征的疾病机制。
对现有疾病的新解释
“对于临床研究,我们的研究可能会产生令人大开眼界的效果,”Malte Spielmann说,他与Denes Hnisz和Denise Horn一起领导了这项研究。“将来,我们当然可以阐明一些遗传疾病的原因,并希望有一天能够治疗它们。
然而,“即使有我们的新知识,BPTAS等先天性遗传疾病也几乎不可能治愈”,霍恩说。“因为畸形已经在子宫内发展,所以它们在发育之前必须用药物治疗。这将很难做到。
但肿瘤疾病也主要是由遗传决定的,Hnisz补充说:“细胞凝聚物和相关相分离是细胞的基本机制,也在癌症中发挥作用。为此开发靶向疗法的机会要大得多。
声明本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们