
ATTRIBUTIONLICENSE 3 0 (CC BY 3 0) 是一种公共领域许可,允许以大多数形式使用或重复使用许可作品,前提是 (A) 对原始来源和作者
ATTRIBUTIONLICENSE 3.0 (“CC BY 3.0”) 是一种公共领域许可,允许以大多数形式使用或重复使用许可作品,前提是 (A) 对原始来源和作者身份做出应有的承认
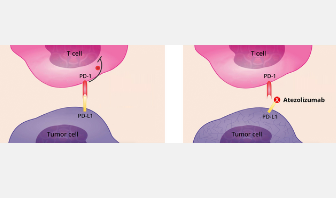
由国立卫生研究院下属的国家癌症研究所 (NCI) 领导的一项临床试验首次批准了一种治疗晚期肺泡软部肉瘤 (ASPS) 的方法。免疫治疗药物atezolizumab (Tecentriq) 最近获得食品和药物管理局(FDA)的批准,用于治疗患有已扩散到身体其他部位或无法通过手术切除的ASPS 的成人和2 岁及以上儿童。
ASPS 是一种极为罕见的癌症,主要影响青少年和年轻人。该批准基于非随机 2 期试验 ( NCT03141684 ) 的数据,该试验由 NCI 资助,由 NCI 癌症治疗和诊断部 (DCTD) 发展治疗诊所的医学博士 Alice Chen 领导。基因泰克是罗氏集团的成员,也是 atezolizumab 的制造商,通过合作研发协议向 NCI 提供该药物。研究结果正在准备发表。
“40% 的患者在贝塞斯达的 NIH 临床中心接受治疗,”DCTD 主任、医学博士 James H. Doroshow 说。研究。”
“这一批准将对治疗特别具有挑战性的罕见疾病产生巨大影响,”陈博士指出。
这是对 ASPS 最大的研究。这也是在 NCI 资助的实验治疗临床试验网络中进行的第一项获得药物批准的研究。该网络使北美各地学术医疗中心的肉瘤专家能够招募患者参与试验。
“对于实验治疗临床试验网络的研究人员以及 ASPS 患者社区和罕见癌症研究来说,这是一个重要的里程碑,”研究负责人之一、DCTD 的医学博士 Elad Sharon 说。
这也是 atezolizumab 首次获批用于儿童。Chen 博士指出,这得益于 NCI 癌症研究中心儿科肿瘤科的参与,该科帮助招募儿童参与试验。
“这项研究是儿科和肿瘤内科合作的一个重要例子,它使患有非常罕见癌症的儿童能够获得有效的新疗法,”儿科肿瘤科医学博士、哲学博士约翰·W·格洛德 (John W. Glod) 说。“整个研究团队感谢参与研究并使这项工作成为可能的患者。”
每年约有 80 人被诊断出患有 ASPS。这种疾病通常始于连接并包围器官和其他组织的软组织。虽然这种疾病发展缓慢,但一旦扩散往往是致命的,而且化疗无效。大约 50% 的转移性疾病患者在五年后仍然存活。新的靶向治疗,包括称为酪氨酸激酶抑制剂的药物,没有持久的效果。然而,最近,免疫治疗药物显示出有望作为 ASPS 的可能疗法。
Atezolizumab 是一种抗 PD-L1 免疫检查点抑制剂,其作用是帮助免疫系统对癌症做出更强烈的反应。FDA 已批准 atezolizumab 用于治疗多种癌症类型的患者,包括肝癌、黑色素瘤和肺癌。
2020 年,FDA 授予 atezolizumab 治疗不可切除或转移性 ASPS 患者的突破性疗法认定。这一指定意味着旨在治疗严重疾病的 atezolizumab 符合 FDA 加快药物开发和审查的标准。同年晚些时候,FDA 授予 atezolizumab 治疗一般软组织肉瘤的孤儿药称号。这种地位为公司开发罕见病药物提供了动力。
2 期试验招募了 49 名 2 岁及以上患有转移性 ASPS 的不同种族患者,他们每 21 天接受一次 atezolizumab 输注。根据医生的评估,大约三分之一的患者对治疗有一定程度的肿瘤缩小反应。大多数其他患者病情稳定。
经过两年的治疗,患者有机会停止治疗并在密切监测下进行长达两年的治疗中断。在此期间,中断治疗的患者均未出现疾病进展。
41% 接受 atezolizumab 治疗的患者出现严重副作用;这些包括贫血、腹泻、皮疹、头晕、高血糖和四肢疼痛。然而,没有患者因为副作用而退出研究。
“这一批准代表了罕见疾病的胜利,这些疾病在临床试验中研究不足,”陈博士说。“对于一种罕见疾病的批准,并能够对这些年轻人的生活产生影响,是非常重要的。”
研究团队现在正在对 ASPS 患者使用 atezolizumab 进行额外的试验,包括将该药物与其他疗法联合使用。
声明本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们