
胰腺癌仍然是全球最致命的恶性肿瘤之一。由于胰腺导管腺癌 (PDAC) 患者的五年生存率仅为 3% 左右,因此在全球范围内,PDAC 很难通过手
胰腺癌仍然是全球最致命的恶性肿瘤之一。由于胰腺导管腺癌 (PDAC) 患者的五年生存率仅为 3% 左右,因此在全球范围内,PDAC 很难通过手术治疗。要开发新的治疗方法,需要更好地了解 PDAC 在分子水平上的生物学特性。
在最近发表在《癌症科学》杂志上的一篇文章中,东京医科齿科大学 (TMDU) 的研究人员发现了一种新的靶基因,该基因在 PDAC 病例中具有很强的临床意义。
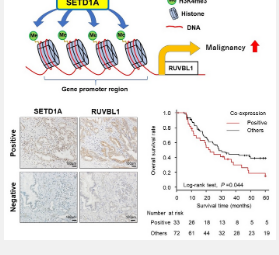
先前的研究表明,癌细胞会高水平表达一种由SETD1A基因编码的特殊酶——组蛋白 H3K4 甲基转移酶。这种酶通过称为甲基化的过程向特定靶基因的组蛋白(染色质的基本结构成分)添加甲基化学基团来调节基因表达。然而,导致这种酶过度表达的机制及其对癌细胞的影响仍不清楚。组蛋白甲基化后,目标基因变得活跃。如果SETD1A靶基因可以支持癌症的发展和进展,这一点尤其重要。因此,TMDU 的研究人员对了解SETD1A过表达在 PDAC 中的作用产生了兴趣。
“虽然之前的研究表明SETD1A在胃癌和肺癌等多种癌症中过度表达,但 PDAC 中SETD1A的特定分子事件尚不清楚,”主要作者 Takeshi Ishii 说。“ PDAC 中的SETD1A靶基因也尚未确定。”
研究人员在他们分析的 51.4% 的人类 PDAC 样本中观察到高水平的SETD1A表达。他们还确定SETD1A是无病生存的独立预后因素,这意味着在肿瘤切除后,SETD1A水平高的患者处于无病状态的时间比SETD1A水平低的患者短。这些结果证明了 PDAC 中SETD1A表达 的临床重要性。
然后,他们使用人工培养的 PDAC 细胞来检查改变SETD1A表达将如何影响细胞行为。当它们过表达SETD1A水平时,细胞生长和细胞迁移能力都会增加。在另一组 PDAC 细胞中,研究人员使用分子技术干扰SETD1A表达,然后分析受此影响的其他基因。“使用一种称为 RNA 测序的技术,我们在敲除 SETD1A后检查了整体基因表达,发现另一种称为RUVBL1的基因表达水平较低,”资深作者 Shinji Tanaka 解释说。
进一步的研究表明,SETD1A可以甲基化RUVBL1基因附近的组蛋白并激活其基因表达。敲低PDAC 细胞中的RUVBL1表达具有与早期使用SETD1A干扰观察到的生物学效应相似的生物学效应。“生存率分析显示,SETD1A和RUVBL1水平高的 PDAC 患者总体生存率较差,这表明它们的共表达是这种癌症的重要预后生物标志物,”Takeshi Ishii 说。
该研究结果对 PDAC 中SETD1A和RUVBL1表达的重要性提供了更深入的见解,并可能提供重要的细节,以帮助临床医生为患有这种严重疾病的患者做出关键的治疗决策。
声明本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们