
约翰霍普金斯 Kimmel 癌症中心的研究人员发现了一种新的细胞信号通路,该通路有可能成为侵袭性胰腺癌患者治疗的靶点。在对人类胰腺癌细胞
约翰霍普金斯 Kimmel 癌症中心的研究人员发现了一种新的细胞信号通路,该通路有可能成为侵袭性胰腺癌患者治疗的靶点。
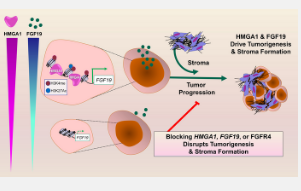
在对人类胰腺癌细胞系和胰腺癌基因工程小鼠模型的实验室研究中,研究人员发现,高迁移率 A1 族 (HMGA1) 蛋白起着“分子开关”的作用,可以“开启”肿瘤细胞生长所需的基因以不受控制的方式形成侵袭性肿瘤。其中一个被 HMGA1 激活的基因导致了由肿瘤细胞分泌的成纤维细胞生长因子 19 (FGF19) 的产生。FGF19 不仅提供诱导肿瘤细胞快速生长并侵入周围组织的信号,而且 HMGA1 和 FGF19 还协同在肿瘤细胞周围“构建”致密、纤维状、疤痕状的壁,这就是所谓的间质。胰腺肿瘤是少数形成致密间质的肿瘤之一,
当科学家们在胰腺癌小鼠模型中沉默 HMGA1 或破坏 FGF19 信号时,肿瘤细胞的生长明显减少,基质形成减少,这表明阻断 FGF19 信号的药物已经可供其他疾病患者使用,可以重新用于治疗胰腺肿瘤具有高水平的 FGF19。癌症基因组研究表明,多达四分之一的人类胰腺癌具有高水平的 HMGA1 和 FGF19。
对这项工作的描述于 3 月 15 日在线发表在《临床研究杂志》上。
“胰腺癌是最顽固的肿瘤之一,确实没有有效的治疗方法,”高级研究作者、约翰霍普金斯大学医学、肿瘤学和病理学教授Linda Resar 医学博士说。她说,许多患者在确诊后 6 到 12 个月内死于胰腺癌,基因组数据表明,与其他胰腺癌患者相比,HMGA1 和 FGF19 水平都高的胰腺癌患者预后更差,生存期甚至更短.
“在之前的工作中,我们发现 HMGA1 在大多数胰腺癌和极晚期前驱病变以及其他侵袭性肿瘤(如白血病和晚期骨髓增生性肿瘤)中过度表达,这向我们表明 HMGA1 在推动肿瘤进展,”Resar 说。
在一系列实验室实验中,Resar 及其同事研究了几种破坏 HMGA1 和 FGF19 的方法。首先,他们使用短发夹 RNA 或阻断基因表达的人工 RNA 分子使来自原发性和转移性肿瘤的胰腺癌细胞系中的 HMGA1 沉默,并观察到 HMGA1 的缺乏导致生长速度下降,损害迁移、侵袭和其他癌特性. 他们还开发了胰腺癌小鼠模型,该模型在胰腺中缺失一个或两个 HMGA1 小鼠基因。令人惊讶的是,仅丢失一个基因就足以减缓肿瘤的形成和进展。
在额外的测试中,研究人员发现 FGF19 基因表达、胰腺癌细胞中的蛋白质水平和分泌都依赖于 HMGA1。此外,沉默 FGF19 反映了沉默 HMGA1 的效果,减少了肿瘤生长和侵袭特性。最重要的是,施用 BLU9931,一种抑制 FGFR4(FGF19 的受体)的小分子药物,导致小鼠肿瘤中的肿瘤生长和基质形成减少。
“我们一起发现了我们认为是以前未描述的范例,肿瘤细胞通过 HMGA1 和 FGF19 协同驱动癌症进展和基质形成,”Resar 说。“这项工作还揭示了 FGF19 作为一种非常具有侵袭性的人类胰腺癌子集的潜在治疗靶点。也许我们研究中最令人兴奋的方面是 FGF19 的抑制剂是可用的,并且已经在人体中进行了测试。”
在正在进行的研究中,研究人员正在评估其他肿瘤以确定它们是否会上调 FGF19 以及是否可以从 FGF19 阻断治疗中获益。研究人员还将测试抑制 FGF19 是否能阻止肿瘤细胞向远处扩散或转移。
声明本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们