
细节决定成败。对于协调生命分子业务的蛋白质,它们的细节中有魔鬼和天使,直到蛋白质的组成原子。正是在这种结构性细节的层面上,健康与疾
细节决定成败。对于协调生命分子业务的蛋白质,它们的细节中有魔鬼和天使,直到蛋白质的组成原子。正是在这种结构性细节的层面上,健康与疾病,甚至生与死的平衡都可以转向。
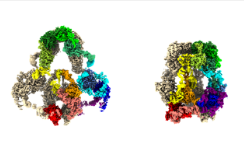
哥伦比亚大学肾脏病学家和神经科学家的合作今天在线发表在《细胞》杂志上,展示了不寻常的联盟所带来的价值。他们和其他地方的同事首次揭示了一种生死攸关的蛋白质的肖像,其清晰度足以最终揭示它是如何工作的:作为分子乘客的微小渡轮,必须穿过从肾脏和大脑到内耳和肺泡的组织和器官中的近一万亿个细胞膜。
“随着对这种关键蛋白质的新机制理解,以及其中的突变如何关闭它,我们希望后续研究将发现治疗肾脏和脑部疾病的新靶点,”哥伦比亚Vagelos内科医生和外科医生学院泌尿学和肾脏病学专家和临床医生Jonathan Barasch博士说。 以及论文的通讯作者。“这些新的治疗开口是由于我的哥伦比亚同事Andrew Beenken,Anthony Fitzpatrick和Larry Shapiro发现了惊人的蛋白质结构。
Barasch博士和他的合著者设想,新的高分辨率蛋白质结构将指向治疗急性肾损伤(在每年影响超过4万患者),慢性肾脏疾病(影响全球约800亿人)和阿尔茨海默病(影响全球约32万人)等疾病的治疗线索。 与Donnai-Barrow综合征(影响不到1,000名人)一样罕见,这是一种具有多种身体和认知后果的遗传性疾病。
这种蛋白质被称为LRP2,是LRP蛋白家族的成员,存在于从蠕虫到人类的生物中。与细胞膜上的大多数蛋白质相比,LRPs是巨大的,以至于在2年代早期发现LRP1980的科学家Marilyn Farquhar和Dontscho Kerjaschki将其称为megalin。一些LRP由4,600多个氨基酸构成,氨基酸是所有蛋白质的分子组成部分。
在肾细胞中,LRP2对于从体液中过滤的代谢废物中回收可重复使用的分子至关重要,因此身体不必花费能量和资源来再次制造它们。对于这些细胞中的每一个,可能有数以万计的LRP2蛋白,像草莓上的种子一样分布在表面。
“肾脏面临着回收通过器官过滤器的身体99%的盐和水,以及回收100%的小蛋白质,否则这些小蛋白质会倾倒到尿液中并排出体外,”Barasch博士说。“关于这种复苏如何运作,已经有了一般的想法,但它的特殊性现在已经解决了。
这就是Barasch博士的同事进来的地方。其中一位是Andrew Beenken,MD,PhD,哥伦比亚大学的生物化学家和肾脏学家,也是该论文的第一作者。众所周知,像LRP家族中的膜蛋白很难分离,更不用说详细绘制了。Beenken博士通过一个艰巨的过程在僵局中迈出了一大步,在这个过程中他部署了一系列生化技术。
“当我第一次听说乔纳森和安德鲁计划做什么时,我认为这是不可能的,”劳伦斯夏皮罗博士说,他是朱克曼研究所的首席研究员,也是哥伦比亚大学Vagelos内外科医学院的生物化学和分子生物物理学教授。夏皮罗博士在梳理蛋白质的复杂结构如何产生其生物学功能方面的专业知识对于破译LRP2的摆渡机制至关重要。
凭借台式技能、创造力和决心的结合,Beenken 博士从 2 个小鼠肾脏中收获了足够的 LRP500 蛋白,将蛋白质固化成足够大小和纯度的样品,以便使用先进的显微镜技术进行分析。在收获LRP2分子的过程中,Beenken博士完成了一次生化之旅:捕获锁定在其两个关键构象中的LRP2蛋白,这是揭示蛋白质在细胞中类似机器的作用的关键实验室壮举。
这是第二个巨大研究步骤出现的地方,这一步骤由共同通讯作者Anthony Fitzpatrick博士领导,他是低温电子显微镜领域的领导者,特别适合研究大蛋白质和其他生物分子。
Fitzpatrick博士和Beenken博士使用两层楼的液氮冷却低温电子显微镜,使用Beenken博士来之不易的LRP2样品收集了大量结构数据。然后,通过巧妙地使用强大的计算工具来理解数据,研究人员产生了近原子细节的3D蛋白质结构。
“我们现在拥有有史以来最好的LRP3蛋白2D图谱,”朱克曼研究所的首席研究员,哥伦比亚大学Vagelos内外科医学院生物化学和分子生物物理学助理教授Fitzpatrick博士说。有了这些地图,夏皮罗博士,也是该论文的通讯作者之一,可以开始梳理LRP2在细胞中起作用的显着机制。
其中一个映射出的构象捕获了LRP2驻留在细胞膜上和细胞膜内的形状。这就是蛋白质从细胞外的液体中获取分子乘客的地方 - 无论是来自肾脏产生的尿液还是脑细胞周围的液体。这些乘客中有小蛋白质,包括tau和淀粉样蛋白β(都与阿尔茨海默病有关),胰岛素和在细胞周围穿梭维生素A和D的蛋白质。
另一种LRP2构象是蛋白质在被一点细胞膜包裹并运送到细胞内位置后卡入的构象。正是在这些小胶囊,内体中,变形蛋白质要么使其分子乘客能够完整地回收以供进一步使用,要么被解构成可重复使用或一次性的组件。
从这对LRP2结构中,研究小组能够确定蛋白质在其乘客登机形式和乘客下船形式之间经历了类似机器的切换。当LRP2蛋白无突变时,它们成功地维持了血液和脑组织中的分子平衡。但是,当LRPs巨大的分子解剖结构中出现微小的调整时,这些蛋白质也会导致疾病。
例如,在肾细胞中,有缺陷的LRP2蛋白违背了它们检索蛋白质的正常任务,否则这些蛋白质会在尿液中丢失。这可能导致各种疾病,包括慢性肾脏疾病,Donnai-Barrow综合征和新生儿阶段致命的疾病。
在大脑中,LRP2(以及相关的LRP1)通常有助于清除各种毒素,其中包括tau蛋白片段,这些毒素长期以来一直与阿尔茨海默病有关。但是LRP家族的蛋白质也被证明可以在脑细胞之间转移这些片段,这可能有助于疾病过程。
“你可以想象,试图用药物抑制这种情况的发生可能会有所帮助,”夏皮罗博士说。
这就是低温电镜的强大之处。
“如果你确切地知道tau结合的原子细节,你实际上可能会使用抗体或小分子来阻止它,”菲茨帕特里克博士说。“冷冻电镜可以让你达到你需要的细节水平,以便研究潜在的新疗法。
“这是发现这些LRP蛋白如何工作以及针对一系列疾病的新药靶点的漫长道路的开始,”Beenken博士说。
声明本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们