
瞬时受体电位香草酸(TRPV1)离子通道是一种多模式伤害感受器,广泛表达于参与痛觉的感觉神经元中,因此在镇痛中发挥重要作用。TRPV1的外孔结
瞬时受体电位香草酸(TRPV1)离子通道是一种多模式伤害感受器,广泛表达于参与痛觉的感觉神经元中,因此在镇痛中发挥重要作用。TRPV1的外孔结构域对于通过温度、质子和其他毒素肽调节该通道至关重要,因此合理设计靶向TRPV1外孔的调节剂是调节疼痛反应的潜在策略。
1月3日,浙江大学基础医学院杨帆、浙江大学脑科学与脑医学学院徐振中、青岛大学药学院齐云坤共同发表了题为“Structure-靶向TRPV1外孔的正变构调节剂的指导肽工程,用于持久镇痛”,发表在《自然通讯》杂志上。
本研究中,研究人员合理设计了一种靶向TRPV1外孔的正变构调节剂(PAM)s-RhTx,发现了sRhTx与TRPV1结合的分子机制,观察了s-RhTx在体内的长效镇痛作用。疼痛模型小鼠。
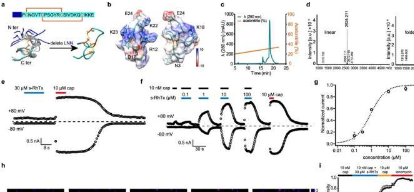
为了开发一种靶向TRPV1外孔的调节剂,研究人员设计了一种基于RhTx的肽PAMs-RhTx,RhTx是一种来自中国红头蜈蚣毒液的有效TRPV1激动剂。与RhTx不同,s-RhTx不能再按设计激活TRPV1。然而,它可以以浓度依赖性方式选择性地增强辣椒素和质子诱发的TRPV1电流,而不改变TRPV1的热激活阈值,表明s-RhTx是TRPV1的PAM。
在分子水平上,研究人员计算了s-RhTx和TRPV1之间的相互作用,并通过分子对接、电生理学和钙成像揭示了E649和E652在外孔域中对s-RhTx活性的关键作用。此外,研究人员进行了热力学突变循环,表明TRPV1外孔中的E652与R12和K22特异性相互作用。
在钙离子存在的情况下,TRPV1在被辣椒素激活后迅速脱敏,而s-RhTx显着减缓了辣椒素诱导的TRPV1脱敏,从而导致表达TRPV1的细胞因钙过载而死亡。这表明低剂量的辣椒素和s-RhTx的组合可以诱导表达TRPV1通道的表皮内神经纤维(IENF)的变性,因此在镇痛中起着至关重要的作用。
为了验证这一假设,研究人员通过同时给予s-RhTx和低剂量辣椒素,评估了s-RhTx在幼稚和炎症疼痛模型小鼠中的镇痛作用。结果表明,该策略可通过促进IENF的可逆性变性而产生持久的镇痛作用。
单次注射s-RhTx的镇痛作用可持续三周以上。值得注意的是,局部递送s-RhTx并没有引起小鼠体温的任何变化,从而克服了常用TRPV1抑制剂影响体温的副作用。
这项研究确定了针对TRPV1外孔的正变构调节剂的开发是一种非常有前途的镇痛策略。它不仅报道了s-RhTx作为镇痛剂,还提出了TRPV1通道中的两个关键残基用于与s-RhTx相互作用,从而为未来开发靶向TRPV1的调节剂奠定了基础。
声明本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
下一篇:理解多细胞生物糖生物学的突破